Tópicos do Artigo
- O que é a Camada de Peptidoglicano?
- Quais São os Reagentes da Coloração de GRAM?
- Passo a passo da Coloração de GRAM
- Preparo do Esfregaço
- Aplicação dos Corantes
- Descoloração
- Aplicação da Safranina
- Como Interpretar no Microscópio?
Se você trabalha em um laboratório de microbiologia ou estuda biologia, já deve ter se deparado com a coloração de Gram. Esse é um daqueles procedimentos clássicos, aparentemente simples, mas que esconde uma série de nuances que separam um resultado medíocre de uma lâmina perfeita para diagnóstico. Muitos manuais tratam o tema de forma genérica, mas aqui, vamos mergulhar fundo nas dicas aplicáveis que os técnicos experientes aprenderam na prática. Este artigo vai além do “pinte com cristal violeta e lave”, focando nos insights que realmente fazem a técnica funcionar. Vamos começar entendendo por que esse método, criado em 1884 por Hans Christian Gram, ainda é tão crucial.
A magia (ou melhor, a química) da coloração de Gram reside na estrutura da parede celular bacteriana. Bactérias Gram-positivas possuem uma espessa e contínua camada de peptidoglicano, que retém fortemente o complexo cristal violeta-iodo após a descoloração. Já as Gram-negativas têm uma fina camada de peptidoglicano”sanduichada” entre uma membrana interna e uma externa, sendo mais facilmente descoloridas/descoradas. É essa diferença estrutural fundamental que o protocolo revela. Curiosamente, a terminologia “gram” nada tem a ver com outras colorações histológicas, como as que identificam um eosinófilo ou um basófilo, que se baseiam na afinidade por corantes ácidos ou básicos de componentes celulares específicos em células de mamíferos. Na microbiologia, falamos de uma reação química e física específica com a parede bacteriana.
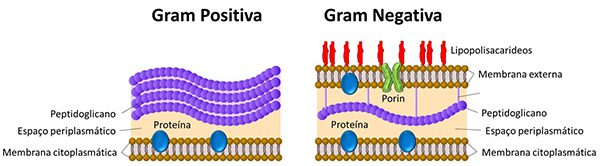
O que é a Camada de Peptidoglicano?
A camada de peptidoglicano é o componente estrutural chave que define a reação à coloração de Gram e é o verdadeiro alvo da técnica. Imagine-a como uma malha ou rede extremamente resistente, construída por longos fios de açúcares (glicanos) entrelaçados por pequenas pontes de peptídeos (proteínas). É essa estrutura que envolve a célula bacteriana, dando-lhe forma, rigidez e proteção contra a pressão osmótica. A grande diferença crucial é que nas bactérias Gram-positivas, essa malha é muito espessa (composta por dezenas de camadas de peptidoglicano) e acessível, formando a parede principal. Durante a coloração, o complexo cristal violeta-iodo fica retido nessa densa rede após a descoloração, resultando na cor roxa. Já nas Gram-negativas, a camada de peptidoglicano é finíssima (apenas uma ou poucas camadas) e fica escondida entre duas membranas lipídicas.
Essa barreira dupla, especialmente a membrana externa, permite que o solvente descolorante (álcool/acetona) penetre facilmente, dissolve os lipídios e lava o complexo de corante da fina malha, deixando a célula incolor para então ser contrastada em rosa pela safranina. Portanto, não é exagero dizer que a coloração de Gram é, na prática, uma coloração indireta para visualizar a espessura e a acessibilidade da camada de peptidoglicano.

Microbiologia – Tortora & Case – 14° Edição – Editora Artmed
Quais São os Reagentes da Coloração de GRAM?
O cristal violeta (ou violeta de genciana) é o corante primário. Precisamos tomar cuidado com uma solução velha ou mal filtrada, pois pode gerar precipitados que se depositam na lâmina, causando artefatos que podem ser confundidos com cocos Gram-positivos. A solução de iodo (mordente) é o que forma o complexo insolúvel dentro da célula. Se ela estiver degradada pela exposição à luz ou ao ar, perde sua eficácia, levando a uma descoloração excessiva e resultados falsamente Gram-negativos. A solução descolorante (álcool ou acetona-álcool) é a etapa mais crítica e que demanda maior habilidade manual. A acetona pura é muito agressiva, enquanto o álcool 95% é mais suave. Muitos laboratórios otimizam usando uma mistura (ex.: 50% acetona, 50% álcool 95%) para obter um controle mais fino. Por fim, o corante de contraste, como a safranina ou fucsina básica, precisa ser de tonalidade forte o suficiente para contrastar vividamente com o azul/roxo inicial.
Uma observação pessoal crucial: Nunca reutilize os frascos dos reagentes entre as etapas. Ter frascos separados para o cristal violeta, o iodo e a safranina, com seus próprios conta-gotas ou copos de imersão, é essencial para evitar a contaminação cruzada dos reagentes. Um único resíduo de cristal violeta no frasco da safranina pode arruinar todas as suas lâminas subsequentes.

Passo a passo da Coloração de GRAM
Aqui vamos ver as etapas do esfregaço, primeira coloração (com cristal violeta), a descoloração e, finalmente, a última coloração (com safranina)
Preparo do Esfregaço
Esta etapa é frequentemente negligenciada. O esfregaço deve ser fino e uniforme. Se for muito grosso, as bactérias de camadas inferiores podem não ser adequadamente descoloridas, mascarando o resultado. Uma dica é espalhar a amostra em uma área do tamanho de uma moeda de um real. Para culturas líquidas, seque bem ao ar e depois fixe passando a lâmina rapidamente (3 a 5 passadas) pela chama do bico de Bunsen. A fixação mata as bactérias e as adere ao vidro. Cuidado: superaquecer a lâmina “cozinha” as bactérias, distorcendo sua morfologia e dificultando a coloração.
Aplicação dos Corantes
Inunde a lâmina com cristal violeta e deixe agir por 1 minuto. Um minuto é suficiente; mais tempo não traz benefícios e pode levar a um excesso de corante que é difícil de lavar. Lave suavemente com água corrente ou destilada em fluxo indireto. O próximo passo é o mordente de iodo (lugol). Inunde e deixe agir por mais 1 minuto. A água da lavagem após o iodo deve sair incolor ou com um leve tom azul. Se sair muito azul, pode ser que a lâmina não tenha sido bem lavada após o cristal violeta.
Descoloração
A descoloração não é uma etapa cronometrada, mas visual. Segure a lâmina inclinada sobre uma pia ou bandeja e pingue a solução descolorante (álcool-acetona) de forma controlada, deixando-a escorrer sobre o esfregaço. Pare imediatamente quando o corante parar de sair da lâmina em fluxo azul/roxo contínuo e passar a sair apenas em gotículas claras ou levemente azuladas. Isso geralmente leva entre 2 a 10 segundos. Lavar em excesso é o erro mais comum dos iniciantes, pois descolora até as bactérias Gram-positivas. Lavar de menos deixa as bactérias Gram-negativas parecendo Gram-positivas.
Aplicação da Safranina
Após a descoloração, lave imediatamente com água para interromper a ação do solvente. Em seguida, aplique o corante de contraste (safranina) por 30 segundos a 1 minuto. Lave, seque suavemente com papel absorvente e sua lâmina está pronta.
Como Interpretar no Microscópio?
Olhar no microscópio é a recompensa. Use a objetiva de imersão (100x) com óleo. Bactérias Gram-positivas aparecerão em um azul/roxo intenso, enquanto as Gram-positivas se apresentarão em um rosa/vermelho. Mas e quando algo dá errado?
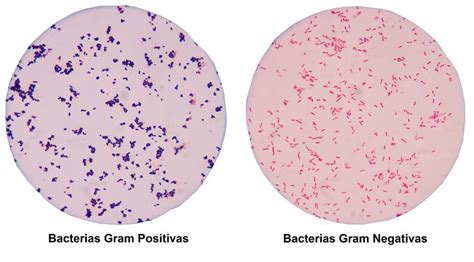
- Todas as bactérias estão vermelhas/rosas: Provável descoloração excessiva. Ou a cultura é muito velha (bactérias Gram-positivas velhas podem perder a capacidade de reter o cristal violeta). Teste com um controle Gram-positivo fresco.
- Todas as bactérias estão azuis/roxas: Descoloração insuficiente. Ou a camada de peptiteoglicano da amostra está alterada. Pode também ser que o corante de contraste (safranina) esteja fraco ou o tempo de aplicação tenha sido muito curto.
- Resultados inconsistentes (manchas claras e escuras): Esfregaço muito grosso e irregular. A descoloração não atuou de forma homogênea.
- Precipitados ou cristais de corante: Filtração inadequada dos reagentes, ou a lâmina não foi seca completamente antes da coloração. Soluções de corante velhas também causam isso.
Referências Bibliográficas:
- FERNANDAFRANCA. Coloração de Gram: O que é e como é realizada. Disponível em: <https://drafranca.com/coloracao-de-gram-microbiologia/>.
- TORTORA, G. J. et al. Microbiologia. [s.l.] Artmed Editora, 2024.
- FERMENTEC. Coloração de Gram: princípios e procedimentos – Fermentec NewsFermentec News. Disponível em: <https://fermentecnews.com.br/2023/10/05/coloracao-de-gram-principios-e-procedimentos/>.
- DANIELA. DOMINIO BACTERIA. Disponível em: <https://carlwoese.blogspot.com/p/dominio-bacteria_24.html>. Acesso em: 11 dez. 2025.
